Imunoterapia Natural

O sistema imunológico despertou uma série de estudos a respeito do seu papel em relação ao câncer. Por ser um sistema natural de defesa, é um mecanismo vigilante contra o surgimento de células alteradas, que dão origem ao câncer.
Nesse sentido, várias áreas da medicina buscam meios de otimizar esse sistema biológico, de modo a elevar sua eficiência. Uma dessas vertentes – mais especificamente a da medicina homeopática – realizou várias pesquisas sobre os imunomoduladores homeopáticos.
As ações imunomoduladoras de medicamentos homeopáticos complexos foram estudadas pelo grupo da Profa. Dra. Dorly de Freitas Buchi na Universidade Federal do Paraná (UFPR), no Laboratório de Pesquisa em Células Neoplásicas e Inflamatórias, entre os anos de 1998 e 2017.

Durante este período 12 teses de mestrado e 6 teses de doutorado foram desenvolvidas, resultando na publicação de 15 trabalhos científicos em periódicos internacionais. Entre as fórmulas estudadas duas apresentaram ações mais eficazes, que foram as fórmulas designadas como M1 e M8 nos experimentos duplo-cegos. Os resultados comprovam a eficácia destas fórmulas no fortalecimento do sistema imunológico frente a células tumorais.
Os imunomoduladores homeopáticos possuem uma ação potencializadora das defesas orgânicas e promovem o fortalecimento da imunidade de forma natural e suave, sem apresentar contraindicações, elevando a qualidade de vida do paciente que está sendo submetido à radioterapia, quimioterapia, entre outros.
Com esse tipo medicamento, o sistema imunológico agirá de forma mais eficaz no combate aos agentes infecciosos e também no controle dos tumores, uma vez que sua ação é fundamental para controlar o surgimento de metástases.
Ações dos Imunomoduladores Homeopáticos
Os estudos realizados in vitro e in vivo demonstraram a ação dos medicamentos homeopáticos M1 e M8 sobre o sistema imunológico e sua interação com células tumorais. Foram analisados macrófagos isolados, bem como células precursoras dos leucócitos na medula óssea e células dos linfonodos, dosagem de citocinas, oxido nítrico e espécies reativa de oxigênio com objetivo de verificar a ação dos medicamentos homeopáticos no microambiente tumoral.
Na fase inicial de formação de alguns tipos de tumores pode ocorrer um processo inflamatório e isto provoca forte reação imunológica. Nesta fase a interação entre sistema imune inato e adaptativo ocorre por meio de alguns leucócitos, com destaque aos macrófagos e células dendríticas, linfócitos T CD4 e CD8, células CD45 que eliminam a maioria das células com tendência tumoral.
Algumas células T tornam-se células de memória, tornando-se reativas a um subsequente encontro com antígeno tumoral. Apesar da resposta inflamatória ocorrer na tentativa de eliminar as células tumorais emergentes, o microambiente tumoral leva a um desequilíbrio bioquímico com o aumento de espécies reativas de oxigênio como ânion superóxido (O2– ) e peróxido de hidrogênio (H2O2) , bem como o aumento de citocinas pró-inflamatórias como o fator de necrose tumoral (TNF-α) o que favorece o surgimento de mecanismos de escape ao controle imunológico, permitindo assim a progressão tumoral.
Ações do M8
A ação do M8 demonstrou aumentar a ativação de macrófagos, porém, diminuindo os níveis de espécies reativas de oxigênio (O2– e H2O2), bem como, diminuindo os níveis de TNF-α (figura 1). O TNF-α é o principal mediador da resposta inflamatória aguda e é responsável por muitas das complicações sistêmicas de infecções graves. A produção prolongada de TNF-α causa perda de células musculares e adiposas, que é uma condição chamada de caquexia. Esta perda resulta da supressão do apetite induzida pelo TNF-α.
Estudos realizados in vitro com monócitos humanos diferenciados em macrófagos também demonstraram diminuição dos níveis de TNF-α após tratamento com M8 nas células que foram desafiadas com lipopolissacarídeo de parede bacteriana (LPS). Na presença de LPS os macrófagos aumentam a produção de TNF-α, contudo na cultura de macrófagos tratados com M8 a presença de LPS não foi capaz de estimular a produção de TNF-α na mesma proporção (de OLIVEIRA et al. 2011).
Pacientes com câncer e em tratamento com quimioterapia normalmente apresentam a condição de caquexia ou grande debilidade física. Contudo os pacientes que fizeram uso do M8, como tratamento adjuvante da quimioterapia, relataram um apetite normal, ausência de perda de peso e uma manutenção da resistência orgânica durante o tratamento convencional, condição que poderia ser justificada pela diminuição da produção de TNF-α pelo M8. A diminuição dos níveis TNF-α também foi observada com o M1, contudo de forma mais moderada do que com o M8.
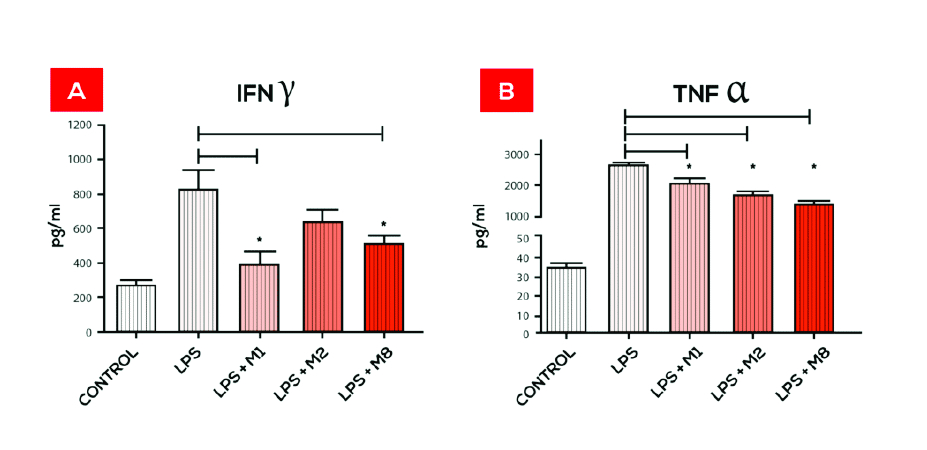
Figura 1. Produção de Citocinas após o tratamento com M1, M2, e M8.
Monócitos humanos foram isolados e diferenciados em macrófagos. A habilidade dos macrófagos em fator de necrose tumoral-alfa (TNF-α) quando desafiados com cada um dos medicamentos, na presença de 5 μg/mL de LPS foi determinada após 48 horas no sobrenadante da cultura usando kit CBA. A fluorescência foi detectada por citometria de fluxo e os testes estatísticos ANOVA e Tukey foram usados para determinar as diferenças estatísticas Figura 1 A – macrófagos estimulados com LPS diminuíram a produção de IFN -g após o tratamento com M1 e M8. Figura 1 B – liberação de TNF-α diminuiu após tratamento com cada um dos medicamentos. *p < 0.05. FONTE: de Oliveira et al. BMC Complementary and Alternative Medicine 2011, 11:101 http://www.biomedcentral.com/1472-6882/11/101
As análises das células da medula óssea demonstraram que o M8 foi capaz de estimular a proliferação e diferenciação celular. O M8 levou também a um aumento do número de linfócitos T citotóxicos nos linfonodos (figura 2). Um estudo in vitro utilizando co-cultura de linfócitos-macrófagos tratados com M8 em presença de uma cultura de células de melanoma B16F10, demonstrou um aumento da atividade antitumoral de linfócitos (GUIMARÃES et al., 2009).
O melanoma maligno é uma forma muito agressiva de câncer de pele. Embora em estágios iniciais possa ser curado cirurgicamente, uma vez no estágio de metástase (estágio IV) ele é praticamente incurável. No referido experimento o M8 indiretamente ativou linfócitos através da interação com macrófagos, o tratamento promoveu estimulação dos linfócitos, resultando no aumento da atividade antitumoral, observada pela diminuição da densidade de células B16F10 e um aumento do número de lise das células tumorais pelos linfócitos ativados. Os linfócitos citotóxicos são um tipo de células do sistema imunológico, que quando devidamente ativadas são responsáveis pela destruição de células infectadas ou células tumorais. Linfócitos ativados pelo tratamento com M8 destruíram as células tumorais mais efetivamente do que os linfócitos controle (sem tratamento).
Medula Óssea
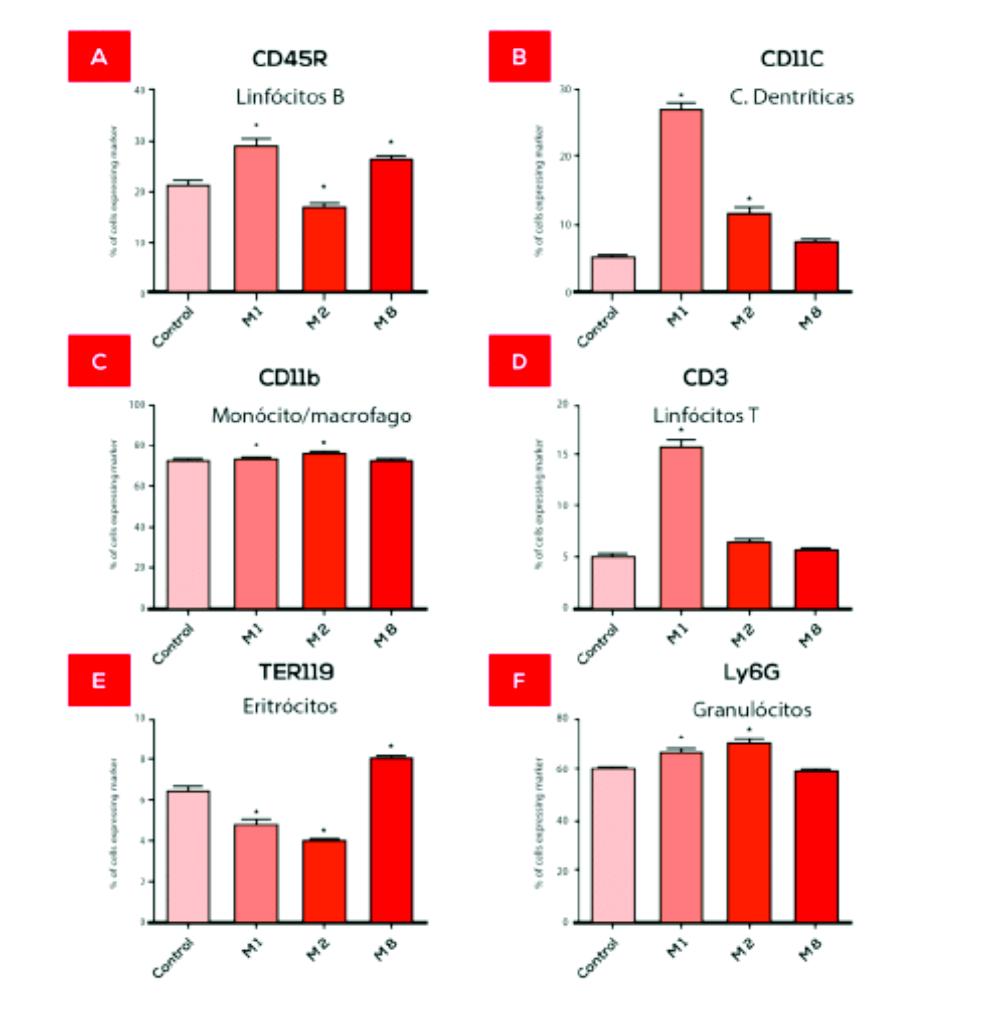
Linfonodos
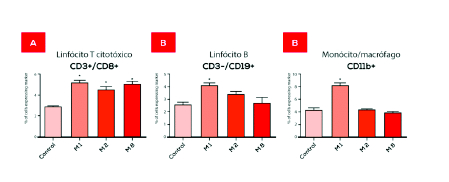
Figura 2. Imunofenotipagem de células de camundongos tratados in vivo.
FONTE: de Oliveira et al. BMC Complementary and Alternative Medicine 2011, 11:101 http://www.biomedcentral.com/1472-6882/11/101
Um estudo in vivo foi também realizado em modelo de metástase pulmonar em camundongos. Utilizando-se a mesma linhagem de células de melanoma B16F10 injetadas por via intravenosa em camundongos. O tratamento com M8 foi realizado 24 horas após a inoculação do tumor e os animais foram tratados com M8 por via inalatória por 14 dias. As células de melanoma injetadas nos camundongos apresentam tropismo pelos pulmões, desenvolvendo nódulos de melanoma nestes órgãos. O grupo de camundongos tratados com M8 apresentou um decréscimo no número de nódulos tumorais nos pulmões quando comparado ao grupo controle (sem tratamento) (figura 3). Uma análise molecular demonstrou que um possível mecanismo de ação do M8 neste experimento seja a diminuição da expressão da molécula de Perlecan, a qual é um componente da matriz extracelular que está fortemente relacionada com vários fatores metastáticos, angiogênicos e invasivos das células tumorais.
Estes resultados demonstraram uma possível dormência celular e decréscimo no número de nódulos tumorais e do seu volume causado pelo tratamento com M8, devido a um decréscimo da adesão e invasão de células malignas (GUIMARÃES et al., 2010). Um estudo de caso em veterinária demonstrou um efeito inibitório do M8 sobre Carcinoma Inflamatório Mamário em cão (figura 4) quando usado em combinação ao anti-inflamatório piroxicam (SILVA et al, 2012).
Estes resultados sugerem que M8 é uma terapia promissora que pode melhorar a resposta imune inata contra células tumorais.
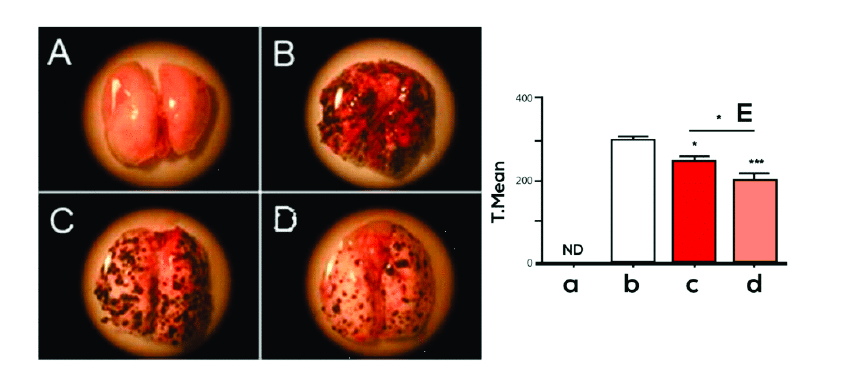
Figura 3. Metástase pulmonar em camundongos induzida por linhagem de melanoma B16F10 injetada via veia caudal.
A – Pulmão normal
B – Pulmão com metástase B16F10 não tratado com M8
C – Pulmão com metástase B16F10 tratado com veículo alcoólico
D – Pulmão com metástase B16 f10 tratado com M8
Tratamento causou uma diminuição estatisticamente significativa na metástase (***P< 0,001) – Fonte: Guimarães et al. BMC Cancer 2010, 10:113

Carcinoma Inflamatório Mamário Canino tratado com Medicamento por via oral (gotas) e tópico (gel). (A) Sinais clínicos do Carcinoma mamário antes do tratamento. (B) Após 7 dias de tratamento. (C) nenhum sinal clínico após 60 dias de tratamento. Fonte: SILVA et al., 2012
Ações do M1
Com o M1 foi demonstrada também a ação anti-tumoral e anti-angiogênica in vivo em camundongos utilizando 2 modelos: 1) metástase de melanoma B16F10; e 2) crescimento subcutâneo. O tratamento com M1 determinou uma diminuição da metástase e do tamanho dos tumores nos pulmões. O crescimento do tumor subcutâneo foi diminuído 38% no grupo tratado com M1. Observou-se uma diminuição da angiogênese e da proliferação das células tumorais. A diminuição da angiogênese ocorreu devido a uma inibição da expressão de um receptor celular para angiotensina II tipo 1 (AT1R) nas células imunossupressoras (Myeloid Derived Supressor Cells – MDSC) pelo tratamento com M1 (FERRARI DE ANDRADE et al., 2016). A diminuição da angiogênese, ou seja, a diminuição da formação de vasos sanguíneos ao redor do tumor, constitui um importante mecanismo anti-tumoral uma vez em que há diminuição do aporte de oxigênio e nutrientes para as células tumorais.
Nos estudos in vitro e in vivo sobre células do sistema imunológico de camundongos, analisando-se os efeitos do M1 sobre macrófagos isolados, bem como células precursoras dos leucócitos na medula óssea e células dos linfonodos, obteve-se resultados similares ao M8 no que se refere a ativação de macrófagos, diminuição de espécies reativas de oxigênio, aumento dos níveis de NO. A diminuição dos níveis TNF-α (figura 1) também foi observada, contudo de forma mais moderada do que com o M8. A imunofenotipagem das células da medula óssea e dos linfonodos demonstrou que M1 aumentou monócitos-macrófagos e linfócitos B na medula óssea e nos linfonodos e aumentou linfócitos CD3 e granulócitos somente na medula óssea (figura 2). Assim como o M8, o M1 aumentou a imunidade inata (celular), porém aumentou também a imunidade adquirida (humoral). O tratamento com M1 demonstra uma possível ação geral no sistema imunológico aumentando ambos imunidade inata e adquirida o que é importante para várias doenças incluindo alguns tipos de câncer.
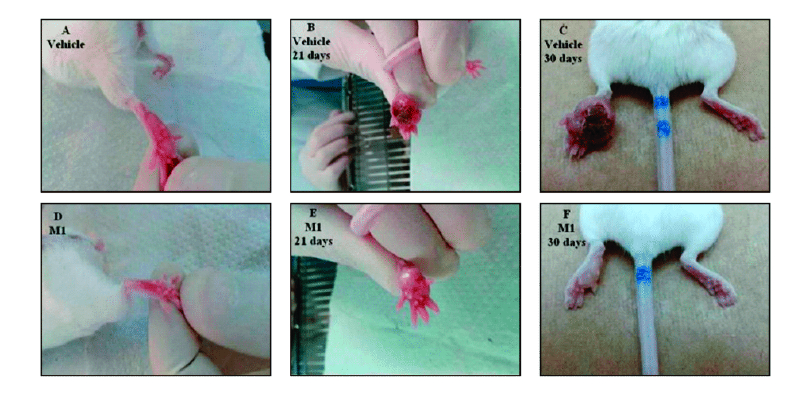
Figura 5. Imagem da evolução da injúria causada por inoculação de L. amazonensis em pata esquerda de camundongo.
O tratamento foi realizado diariamente, após 60 dias da inoculação, durante 30 dias consecutivos, com dose de 1 mL por dia. O grupo controle foi tratado oralmente com o veículo de diluição homeopática (A-C). O grupo tratado com M1 (D-F) por 30 dias consecutivos. A presença de lesões ulcerativas e crostas são vistas em B e C, um edema é visto em E, mas lesões menores são vistas em E e F (*p<0,05). Fonte – NASCIMENTO, et al., Cytokine 99 (2017) 80-90
O M1 demonstrou uma resposta efetiva contra Leishmania (L) amazonensis em experimentos in vivo e in vitro. A Leishmania é um parasita intracelular obrigatório que infecta macrófagos e pode causar uma doença inflamatória crônica envolvendo muitos tecidos. A leishmaniose cutânea, a forma mais comum da doença, causa úlcera em partes expostas do corpo, levando à desfiguração, cicatrizes permanentes, estigma e, em alguns casos, incapacidade. A infecção por Leishmania, em camundongos, tem servido como sistema modelo para o estudo das funções efetoras de vária citocinas e dos subgrupos de linfócitos T auxiliares que as produzem. As respostas TH1 à Leishmania e a produção associada de interferon gama (IFN-γ) controlam a infecção enquanto a resposta TH2 com produção de IL-4 leva à doença letal disseminada. Os macrófagos tratados com M1 e infectados com L. amazonensis aumentaram a produção de IFN-γ após 2 h de infecção e este aumento foi maior ainda após 18 horas de infecção.
O conjunto dos resultados obtidos no estudo, permitem concluir que, em geral, o M1 desenvolveu respostas efetivas por organismos vivos, células e camundongos, contra Leishmania amazonensis. Portanto, o M1 pode ser um bom candidato a uma terapia complementar aos tratamentos convencionais com atividade leishmanicida, já que ambos os parâmetros observados in vitro e in vivo melhoraram. Podemos afirmar que M1 evita a evolução e progressão da leishmaniose, aumentando a resposta Th1 em conjunto com o aumento de IL 10, que pode equilibrar a inflamação local e evitar a exacerbação desses processos (NASCIMENTO et al., 2017). A figura 5 ilustra a infecção por Leishmania em pata de camundongo e a ação do tratamento com M1.
Conclusão
Os imunomoduladores homeopáticos M1 e M8 representam uma possibilidade terapêutica adjuvante aos tratamentos convencionais, pois, comprovadamente, agem na modulação das respostas imunológicas levando a alterações bioquímicas e celulares que colaboram para a contenção da progressão tumoral e de infecções. Podem ser usados em qualquer situação em que o sistema imunológico esteja debilitado ou encontre-se excessivamente desafiado, como nas infecções, ou ainda nos processos que exigem a participação de macrófagos na reparação tecidual como, por exemplo, na cicatrização. Por se tratar de medicamentos sem toxicidade, sem mutagenicidade e de baixo custo, podem ser prescritos como adjuvante de tratamentos convencionais ou para a prevenção de doenças infecciosas, ou de desenvolvimento tumoral.
Resumo das ações do M8
ativação de macrófagos diminuição de espécies reativas de oxigênio (diminuição de processo inflamatório e dano celular)
diminuição de TNF-α (diminuição do processo inflamatório e da caquexia) aumento do número de linfócitos T citotóxicos nos linfonodos
aumento da atividade antitumoral de linfócitos T citotóxicos diminuição da metástase pulmonar das células de melanoma
Resumo das ações do M1
ativação de macrófagos e diminuição de espécies reativas de oxigênio diminuição de angiogênese e da proliferação das células tumorais aumento de monócitos-macrófagos e linfócitos B na medula óssea aumento de linfócitos T nos linfonodos melhora imunidade inata (celular) e adquirida (humoral)
Características importantes destes medicamentos
São complexos homeopáticos altamente diluídos Não apresentam nenhuma toxicidade ou mutagenicidade Modulam o sistema imunológico para combater o câncer e doenças infecciosas Podem ser usados em combinação com outras terapias convencionais tais como quimioterapia e radioterapia O medicamento deve ser dinamizado antes da sua utilização
Referências Bibliográficas
GUIMARAES, FERNANDO SF; ABUD, ANA PR; OLIVEIRA, SIMONE M; OLIVEIRA, CAROLINA C; CESAR, BEATRIZ; ANDRADE, LUCAS F; DONATTI, LUCELIA; GABARDO, JUAREZ; TRINDADE, EDVALDO S; BUCHI, DORLY F. Stimulation of lymphocyte anti-melanoma activity by co-cultured macrophages activated by complex homeopathic medication. BMC Cancer, v. 9, p. 293, 2009
GUIMARÃES, FERNANDO SF; ANDRADE, LUCAS F; MARTINS, SHARON T; ABUD, ANA PR; SENE, REGINALDO V; WANDERER, CARLA; TISCORNIA, INÉS; BOLLATI-FOGOLÍN, MARIELA; BUCHI, DORLY F; TRINDADE, EDVALDO S. In vitro and in vivo anticancer properties of a Calcarea carbonica derivative complex (M8) treatment in a murine melanoma model. BMC Cancer, v. 10, p. 113, 2010.
SILVA D.M. et al. Oral, topical, and inhalation of Calcarea carbonica derivative complex (M8) to treat inflammatory mammary carcinoma in dogs. Int J High Dilution Res 2012, 11(40). Proceedings of the XXVI GIRI Symposium; 2012 Florence (Italy)
CESAR, BEATRIZ; ABUD, ANA PAULA R.; DE OLIVEIRA, CAROLINA C.; CARDOSO, FRANCOLINO; BERNARDI, RAFFAELLO POPA DI; GUIMARÃES, FERNANDO S. F.; GABARDO, JUAREZ; DE FREITAS BUCHI, DORLY . Treatment with at Homeopathic Complex Medication Modulates Mononuclear Bone Marrow Cell Differentiation. Evidence-Based Complementary and Alternative Medicine, v. 2011, p. 1-10, 2011.
DE OLIVEIRA, CAROLINA C; ABUD, ANA PAULA R; DE OLIVEIRA, SIMONE M; GUIMARAES, FERNANDO DE SF; DE ANDRADE, LUCAS F; DI BERNARDI, RAFFAELLO P; COLETTO, EDIELY L DE O; KUCZERA, DIOGO; DA LOZZO, ENEIDA J; GONCALVES, JENIFER P; TRINDADE, EDVALDO DA S; BUCHI, DORLY DE F. Developments on drug discovery and on new therapeutics: highly diluted tinctures act as biological response modifiers. BMC Complementary and Alternative Medicine, v. 11, p. 101, 2011.
FERRARI DE ANDRADE, LUCAS; MOZELESKI, BRIAN; LECK, ALINE RAQUELL; ROSSI, GUSTAVO; DA COSTA, CLEBER RAFAEL VIEIRA; DE SOUZA FONSECA GUIMARÃES, FERNANDO; ZOTZ, RAFAEL; FIALHO DO NASCIMENTO, KATIA; CAMARGO DE OLIVEIRA, CAROLINA; DE FREITAS BUCHI, DORLY; DA SILVA TRINDADE, EDVALDO. Inhalation therapy with M1 inhibits experimental melanoma development and metastases in mice. Homeopathy (Edinburgh. Print), v. 105, p. 109-118, 2016.
NASCIMENTO, KATIA FIALHO; DE SANTANA, FABIANA RODRIGUES; DA COSTA, CLEBER RAFAEL VIEIRA; KAPLUM, VANESSA; VOLPATO, HELITO; NAKAMURA, CELSO VATURO; BONAMIN, LEONI VILLANO; DE FREITAS BUCHI, DORLY . M1 homeopathic complex trigger effective responses against Leishmania (L) amazonensis in vivo and in vitro. CYTOKINE, v. 99, p. 80-90, 2017.
